
Journal de Chirurgie Viscérale
DÉCOUVREZ NOS OFFRESArticle en libre accès
Stratégies de prise en charge des polypes vésiculaires
Journal de Chirurgie Viscérale • Volume 157 • Issue 5 • October 2020 • Pages 419-427
Article en libre accès
Stratégies de prise en charge des polypes vésiculaires The management of gallbladder polyps
C. Valibouzea, M. El Amrania,S. Truanta, C. Leroyb,
G. Milleta, F.R. Pruvota, P. Zerbiba
aService de chirurgie digestive et transplantation, université Lille Nord de France, hôpital Claude-Huriez, CHU de Lille, 59037 Lille, France
bService de radiologie et imagerie digestive et endocrinienne, université Lille Nord de France, hôpital Claude-Huriez, CHU de Lille, 59037 Lille, France
Résumé
Les polypes vésiculaires vrais (PVV) sont rares, avec une prévalence dans la population générale inférieure à 10 %. Les PVV, qui présentent un risque de dégénérescence, doivent être distingués des autres formations polypoïdes vésiculaires bénignes qui sont plus fréquentes. Les PPV sont des adénomes et le risque principal lié à leur prise en charge est de laisser évoluer un cancer vésiculaire au pronostic particulièrement sombre. De récentes recommandations européennes ont tenté d’uniformiser la prise en charge des PVV, à partir d’études essentiellement rétrospectives avec de faibles effectifs, amenant à des conclusions d’un faible niveau de preuve. L’échographie abdominale est l’examen de première intention pour le diagnostic et le suivi d’un PVV. Afin de prévenir l’apparition d’un authentique cancer vésiculaire ou de traiter une dégénérescence à une phase précoce, tout PVV de plus de 10 mm, ou symptomatique, ou de plus de 6 mm associé à des facteurs de risque de cancer (âge supérieur à 50 ans, polype sessile, ethnie indienne ou patient atteint d’une cholangite sclérosante primitive) justifie une cholécystectomie. En dehors de ces situations, la surveillance échographique est recommandée pendant au moins 5 ans avec indication à une cholécystectomie en cas de croissance du PVV de plus de 2 mm. La cœlioscopie est une approche possible mais lorsque le risque de perforation vésiculaire peropératoire est jugé trop important, la conversion en laparotomie doit être préférée pour éviter une potentielle dissémination tumorale intra-abdominale. Lorsqu’on suspecte un PVV dégénéré (taille supérieure à 15 mm, signes d’extension locorégionale à l’imagerie), un bilan morphologique exhaustif doit être réalisé pour rechercher notamment une extension hépatique. Dans ces cas, une chirurgie radicale doit être envisagée.
© 2020 Elsevier Masson SAS. Tous droits réservés.
Summary
Neoplastic gallbladder polyps (NGP) are rare; the prevalence in the overall population is less than 10 %. NGP are associated with a risk of malignant degeneration and must be distinguished from other benign gallbladder polypoid lesions that occur more frequently. NGP are adenomas and the main risk associated with their management is to fail to detect their progression to gallbladder cancer, which is associated with a particular poor prognosis. The conclusions of the recent European recommendations have a low level of evidence, based essentially on retrospective small-volume studies. Abdominal sonography is the first line study for diagnosis and follow-up for NGP. To prevent the onset of gallbladder cancer, or treat malignant degeneration in its early phases, all NGP larger than 10 mm, or symptomatic, or larger than 6 mm with associated risk factors for cancer (age over 50, sessile polyp, Indian ethnicity, or patient with primary sclerosing cholangitis) are indications for cholecystectomy. Apart from these situations, simple sonographic surveillance is recommended for at least five years; if the NGP increases in size by more than 2 mm in size, cholecystectomy is indicated. Laparoscopic cholecystectomy is possible but if the surgeon feels that the risk of intra-operative gallbladder perforation is high, conversion to laparotomy should be preferred to avoid potential intra-abdominal tumoral dissemination. When malignant NGP is suspected (size greater than 15 mm, signs of locoregional extension on imaging), a comprehensive imaging workup should be performed to search for liver extension: in this setting, radical surgery should be considered.
© 2020 Elsevier Masson SAS. All rights reserved
Mots clés : Vésicule biliaire ; Polype ; Cancer ; Cholécystectomie ; Cœlioscopie
Keywords : Gallbladder; Polyp; Cancer; Cholecystectomy; Laparoscopy
Plan
Introduction
On désigne par « formation polypoïde vésiculaire » (FPV) toutes les élévations de la muqueuse vésiculaire visualisées en imagerie. Parmi ces FPV, on distingue les polypes vésiculaires vrais (PVV) et les « pseudo polypes ». Les « pseudo polypes » sont les plus fréquents (environ 70 % des FPV), principalement représentés par les polypes cholestériques, bénins et ne nécessitent aucune surveillance ou traitement particulier [1]. En revanche, les PVV sont des adénomes à risque de dégénérescence en adénocarcinome vésiculaire de pronostic particulièrement sombre [1—3]. La prévalence des PVV a été variable dans la littérature, estimée entre 0,3 et 10 % [1,4]. Ils sont le plus souvent pauci ou asymptomatiques, découverts fortuitement sur une imagerie abdominale ou sur une pièce de cholécystectomie [5]. Les facteurs de risque de PVV ne sont pas clairement identifiés même s’il semble exister une association avec l’infection chronique par le virus de l’hépatite B, l’obésité et le syndrome métabolique [4]. De rares syndromes génétiques semblent également être associés aux PVV comme l’acromégalie ou encore la polypose adénomateuse familiale qui favoriserait le développement de PVV multiples de la vésicule biliaire selon le même mécanisme génétique à l’origine des polypes colorectaux (mutation du gène APC) [6,7]. Le processus de transformation néoplasique des PVV a été peu étudié mais pourrait suivre la même séquence dégénérative que les polypes colorectaux avec une évolution lente mais inexorable vers le cancer de la vésicule biliaire [8].
La gravité du cancer vésiculaire nécessite de dépister les PVV et d’identifier, parmi eux, ceux à risque de dégénérescence nécessitant une cholécystectomie. En effet, la cholécystectomie systématique pour l’ensemble des PVV n’est pas justifiée du fait de la morbidité opératoire (0,5 à 1 % de plaies des voies biliaires), du faible taux de cancers découverts sur PVV (7 à 8,4 %), et des contraintes médico-économiques plaident plus pour une stratégie de dépistage des PVV à risque de dégénérescence plutôt que pour une intervention systématique [9—11]. Une projection de résultats obtenus dans une série rétrospective a montré qu’une surveillance par échographie associée à une cholécystectomie ciblée pour les patients à risque pouvait prévenir 5,4 cancers vésiculaires pour 1000 patients par an et permettre une économie de plus de $200 000 par an par rapport à une intervention systématique pour tout PVV [5].
La rareté des PVV et la méconnaissance de leur histoire naturelle ont conduit à une inhomogénéité de prise en charge. Dans ce contexte, des sociétés savantes européennes de radiologie abdominale, de chirurgie viscérale et d’endoscopie digestive (European Society of Gastrointestinal and Abdominal Radiology [ESGAR], European Association for Endoscopic Surgery and other Interventional Tech-niques [EAES], International Society of Digestive Surgery - European Federation [EFISDS] and European Society of Gastrointestinal Endoscopy [ESGE]) ont en 2017 élaboré par méthode DELPHI des recommandations de prise en charge des PVV découverts par imagerie [12]. Ces recommandations sont cependant d’un faible niveau de preuve puisque élaborées à partir d’études majoritairement rétrospectives et monocentriques, portant sur de faibles effectifs, et essentiellement pour des PVV larges ou symptomatiques. Toutefois, une étude observationnelle prospective multicentrique néerlandaise débutée en juin 2018 (fin des inclusions prévues en juin 2022) pourrait permettre de mieux comprendre l’histoire naturelle des PVV et ainsi d’affiner les indications opératoires et les modalités de surveillance [13].
Actuellement, ni la taille de 10 mm du PVV ni les moyens d’imagerie ne sont suffisants pour prédire avec certitude le risque de dégénérescence, et le risque d’opérer les patients par excès ou pire d’opérer trop tard au stade de cancer, existe toujours. Nous avons tenté dans ce travail, au moyen d’une revue de la littérature, de clarifier l’attitude de prise en charge d’un PVV de découverte fortuite en imagerie.
Diagnostic positif
L’échographie trans-cutanée (ETC)
C’est l’examen recommandé en première intention pour le diagnostic positif et différentiel d’un PVV en raison de son accessibilité, de son faible coût et de son efficacité diagnostique (100 % d’accord d’experts, faible niveau de preuve dans les recommandations européennes) [12].
Une méta-analyse et une revue systématique de la littérature portant chacune sur plus de 15 000 patients ont rapporté une sensibilité et une spécificité diagnostiques de l’ETC de respectivement 84 % et 96 % [14,15]. Des manœuvres positionnelles (décubitus latéral gauche, procubitus) et d’ébranlement de la vésicule sont indispensables pour analyser la mobilisation du polype et identifier d’éventuels calculs associés.
En ETC, le PVV se présente sous la forme d’une lésion le plus souvent unique, vascularisée au Doppler, hypo- ou anéchogène, sessile ou pédiculée sur la paroi vésiculaire, immobile au changement de position et sans cône d’ombre postérieur à la différence du calcul (Fig. 1 A) [2,16].
L’ETC présente cependant certaines limites :
- cet examen reste particulièrement opérateur-dépendant et doit donc être répété en cas de doute par un radiologue expérimenté ;
- pour des PVV infracentimétriques, sa spécificité diagnostique entre un PVV ou une FPV d’une autre nature diminue ;
- elle peut être difficilement interprétable chez le patient obèse, lors d’interposition d’anses digestives ou de vésicule multilithiasique.
Dans les cas difficiles, d’autres examens complémentaires peuvent être utiles au diagnostic.
Autres moyens diagnostiquesL’utilisation d’autres examens complémentaires peut se justifier en cas de doute diagnostique, notamment avec un polype malin (100 % d’accord d’experts, faible niveau de preuve dans les recommandations européennes) [12].
L’échographie de contraste : peu coûteuse, elle consiste en l’association d’une échographie conventionnelle et d’une injection de produit de contraste ultrasonore non irradiant (microbulles) permettant une étude fine de la vascularisation. En échographie de contraste, un PVV présente une prise de contraste hyperéchogène en phase artérielle et iso-échogène en phase veineuse (Fig. 1 B) [17]. Elle serait utile pour distinguer un PVV au sein d’une vésicule multilithiasique, pour le diagnostic différentiel avec d’autres FPV (adénomyomatose, polype cholésterolique) et pourrait même être utilisée en première intention [18—20]. Certains auteurs ont souligné son importante sensibilité dans la détection de signes de dysplasie (prise de contraste hétérogène, vascularisation abondante par des vaisseaux tortueux avec un « wash-out » rapide, irrégularité et infiltration des tissus péri-vésiculaires) [17,19,21]. Elle présente ainsi un intérêt dans le bilan préopératoire d’un PVV à fort risque de dégénérescence.
L’IRM a été peu étudiée dans le diagnostic de PVV. Elle est surtout intéressante pour le diagnostic différentiel avec d’autres FPV. Elle est en effet l’examen de référence pour le diagnostic d’adénomyomatose vésiculaire (cf. infra, diagnostic différentiel). Un hypersignal en séquence de diffusion pourrait également apporter des arguments en faveur d’une lésion maligne, sans être toutefois spécifique d’une lésion dégénérée (Fig. 2) [2].
L’intérêt du TEP-scanner a été évalué pour des PVV supra-centimétriques et un hypermétabolisme serait en faveur d’une dégénérescence [22]. Cela dit, cet examen ne permet pas de distinguer un PVV d’autres FPV.
L’échoendoscopie présente une résolution plus importante que l’ETC avec une sensibilité diagnostique voisine [2,15,23]. Elle permet surtout la cytoponction d’adénopathies régionales suspectes.
La sensibilité diagnostique du scanner abdominal est mauvaise car il ne permet pas de détecter les lésions de faible densité. Cet examen devrait être réservé au bilan d’extension des PVV dégénérés. Il faut noter par ailleurs que le scanner sous-estime la taille du PVV par rapport à une mesure échographique (±2 mm) [2].
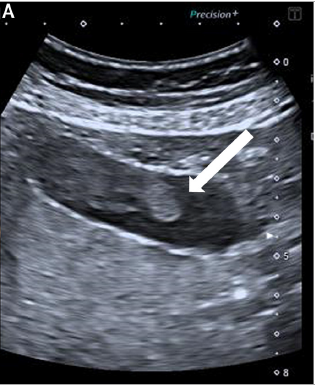
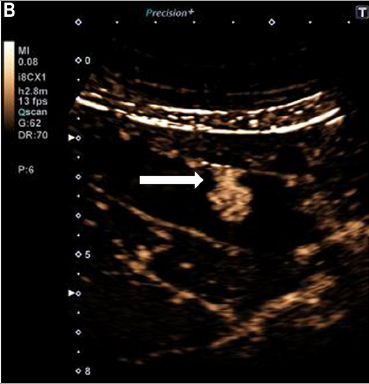
Figure 1. Échographie vésiculaire. A. À droite : image endoluminale (flèche) supra-centimétrique, modérément hyperéchogène, un peu hétérogène, évocatrice de polype adénomateux. B. À gauche : même coupe après injection de produit de contraste : la lésion prend intensément le contraste dans son ensemble, ainsi qu’un niveau de son pédicule (flèche), en faveur d’une lésion tissulaire de type polype adénomateux.
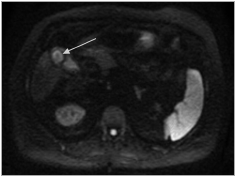
Figure 2. Séquence de diffusion en IRM hépatique montrant l’hypersignal d’un polype vésiculaire malin (flèche).
Diagnostique différentiel
Devant une image de FPV, de nombreux diagnostics peuvent être évoqués avant de retenir celui de PVV. Il est encore fréquent que le diagnostic final ne soit posé que sur l’histologie définitive de la pièce de cholécystectomie.
Ainsi, en fonction du terrain, du contexte clinique et des données morphologiques on peut évoquer :
- les polypes cholestéroliques : ce sont les FPV les plus fréquentes (70 à 80 % des FPV) [9,10,24]. Ils résultent de l’accumulation de triglycérides et d’esters de cholestérol à l’intérieur des macrophages de la paroi vésiculaire [16]. Ils surviennent plus fréquemment chez les femmes, et à un âge inférieur à 50 ans [25—27]. En ETC, ils sont de petite taille (généralement inférieurs à 10 mm), multiples, hyperéchogènes et immobiles au changement de positions ( 3) [2,16,28] ;
- le polype adénomyomateux (ou adénomyose ou adéno-myomatose vésiculaire) (10 % des FPV) [9,28] : il s’agit d’une hyperplasie de l’épithélium et du muscle lisse vésiculaire avec invagination de l’épithélium à travers la musculeuse formant des pseudo-diverticules nommés sinus de Rokitansky-Aschoff. Ces sinus ne sont pas pathognomoniques de l’adénomyose et ont été décrits dans d’autres pathologies comme la cholécystite xanthogranulomateuse [29]. En ETC, l’adénomyose se présente comme une lésion unique ou multiple, sous la forme d’un épaississement vésiculaire (fond, partie moyenne ou collet). Les sinus de Rokitansky-Aschoff se traduisent en ETC par des images pseudokystiques anéchogènes (ou échogène lorsqu’un calcul se loge au sein des sinus). La précipitation de cristaux d’acides biliaires au sein des sinus peut donner des images en « queue de comète » (« comet-tails » ou artefacts de répétition acoustique en V) [12,29]. En cas de doute diagnostique en ETC, une IRM peut montrer soit un simple épaississement pariétal, soit les sinus de Rokitansky-Aschoff au sein de la paroi, soit des images pathognomoniques hyper T2 de microkystes en « collier de perle » ( 4) [29] ;
- les polypes inflammatoires (moins de 5 % des FPV) : il s’agit d’une séquelle fibrosante ou granulomateuse d’une inflammation chronique vésiculaire. En ETC, ils sont classiquement de petite taille (inférieurs à 10 mm) hypo- ou iso-échogènes en fonction de leur taille [9,24] ;
- la cholécystite xanthogranulomateuse est une forme rare de cholécystite chronique. Le mécanisme physio-pathologique à son origine semble être une pénétration de bile dans la paroi vésiculaire par des sinus de Rokitansky-Aschoff rompus ou des ulcérations muqueuses, responsables d’une inflammation pariétale importante. En ETC, elle se traduit par un épaississement focal ou diffus de la paroi de la vésicule biliaire pouvant mimer un PVV ou un cancer vésiculaire. Le scanner et l’IRM hépatique sont souvent réalisés en complément mais le diagnostic de certitude préopératoire reste difficile [30] ;
- un calcul enchâssé dans la paroi vésiculaire peut mimer un PVV. Il perd alors son caractère mobile aux changements de position en échographie mais garde l’aspect de cône d’ombre postérieur [2] ;
- polypes malins non adénocarcinomateux : on a décrit des lymphomes, des sarcomes, des métastases endo-vésiculaires de tumeurs neuroendocrines ou de cancers du rein [31]. Le diagnostic peut être évoqué par des signes radiologiques particuliers (lésions hypervasculaires pour les tumeurs neuroendocrines ou les métastases de cancer du rein, volume important pour les sarcomes, multiples adénopathies à distance pour les lymphomes) et porté par une biopsie percutanée trans-hépatique si la lésion est volumineuse et/ou infiltrante, en particulier au contact du foie ;
- d’autres lésions bénignes plus rares ont été décrites : lipomes, hétérotopies gastriques ou pancréatiques. Leur diagnostic est essentiellement porté sur l’examen histopathologique final de la pièce de cholécystectomie [31].
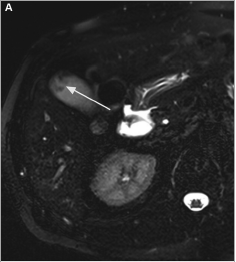
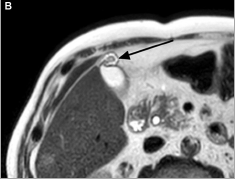
Figure 3. Échographie abdominale : image de polype hyper-échogène infracentimétrique, évocateur de polype cholestérolique (flèche).
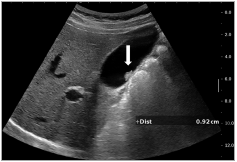
Figure 4. Aspect en IRM (séquence T2) d’une adénomyomatose vésiculaire. A. Adénomyomatose du fond vésiculaire : sinus de Rokitansky-Aschoff (flèche). B. Image typique en « collier de perle » (flèche).
Bilan d’extension
Il se justifie en cas de doute sur un PVV dégénéré pour préciser l’extension locorégionale éventuelle et guider l’étendue de la résection chirurgicale. L’extension hépatique peut être évaluée par une IRM hépatique (hypo-intensité irrégulière du parenchyme adjacent à la vésicule biliaire en séquence T1 injectée) ou une échographie de contraste [32]. Le scanner avec injection permet d’apprécier l’extension notamment ganglionnaire.
Indication de cholécystectomie pour polype vésiculaire vrai
L’indication chirurgicale doit être posée en fonction de la taille du PVV, de sa croissance et des symptômes cliniques [25,33].
En cas de contre-indication chirurgicale ou de refus de la chirurgie, une surveillance s’envisage alors au cas par cas [12].
Taille du polype vésiculaire vrai
Pour les PVV de 10 mm ou plus de grand axe, une cholécystectomie prophylactique est indiquée (89 % d’accord d’experts, niveau de preuve modérée dans les recommandations européennes) [12]. En effet, les PVV malins sont plus gros que les PVV bénins [24,34]. L’objectif est donc de définir une limite de taille et de n’opérer que des PVV à haut risque de dégénérescence.
Le seuil communément admis de 10 mm a été confirmé par les recommandations européennes de 2017 avec un niveau de preuve modéré [12]. À partir de 10 mm, le risque de malignité est augmenté de 25 %. Dans une étude prospective sur 689 patients, une taille supérieure à 10 mm était un facteur de risque indépendant de malignité [35]. De plus, ce seuil de 10 mm permettrait une meilleure distinction entre es PVV et les autres FPV. En effet, dans l’étude de Sarkut et al. portant sur 138 patients, 88 % des polypes d’au moins 10 mm étaient adénomateux et tous étaient dégénérés [36].
Cela dit, la limite de taille précise du PVV comme facteur de risque de malignité reste encore débattue [10,12,37] et certains auteurs ont proposé d’augmenter ce seuil à 12 mm sans majorer le risque de méconnaître un polype malin en histologie définitive [10,33].
Si le seuil de 10 mm d’un PVV est habituellement retenu pour indiquer une cholécystectomie, d’authentiques cancers de la vésicule biliaire ont été découverts sur des PVV inférieurs à 10 mm [1,11,24]. Ainsi, pour les PVV entre 6 et 10 mm, la décision de cholécystectomie doit prendre en compte la présence de certains facteurs de risque de cancer (78 % d’accord d’experts, niveau de preuve faible à modéré dans les recommandations européennes) [12].
Âge
L’âge est connu comme un facteur de risque général de cancer. Dans la revue systématique de Bhatt et al. et l’étude prospective de Chou et al. sur 1204 patients, un âge supérieur à 50 ans augmentait de 7 à 11 fois (respectivement OR : 7,2, 95 %IC : 2,3—22,6 et OR : 11,8, 95 %IC : 7,77—18) le risque de malignité d’un PVV en analyse multivariée [9,24].
Ethnie indienne
L’étude d’Aldouri et al., portant sur 5391 patients résidant en Grande-Bretagne, a montré une augmentation du risque de cancer vésiculaire associé à un PVV par un facteur 13 (HR : 12,92 ; 95 %IC : 3,8—44,3) chez les patients d’origine indienne en comparaison à une population caucasienne [38].
PVV sessile ou épaisseur pariétale vésiculaire supérieure à 4 mm
Le caractère sessile d’un PVV a été corrélé au risque de cancer vésiculaire dans différents travaux, notamment ceux de Yang et al. portant sur 1976 patients (71 % de polypes néoplasiques sessiles, p < 0,001) [34,39]. Dans la revue récente de Bhatt et al., ce risque était multiplié par 7 pour les PVV sessiles (OR : 7,3, 95 %IC : 4,2—12,8) [9]. Une épaisseur de la paroi vésiculaire de plus de 4 mm était également corrélée au risque de cancer [12].
Présence d’une cholangite sclérosante (CSP) associée
Dans 2 séries, le taux de cancer sur PVV était de 60 %lorsqu’il existait une CSP concomitante [40,41]. L’étude rétrospective d’Eaton et al. portant sur 57 cholécystectomies chez des patients atteints de CSP a suggéré qu’à partir de 8 mm la malignité d’un PVV était prédite avec une sensibilité et une spécificité de respectivement 100 % et 70 % [42]. Une cholécystectomie est donc indiquée en cas de PVV associé à une CSP.
Certains facteurs de risque restent controversés et n’imposent pas de cholécystectomie prophylactique systématique :
- la présence d’un calcul vésiculaire associé n’est pas considérée comme un facteur de risque de malignité d’un PVV. Ce risque a été évalué dans plusieurs études rétrospectives avec des résultats discordants et les travaux prospectifs de Park et al. n’ont pas montré que la présence d’un calcul était un facteur de risque de malignité [12,35] ;
- l’élévation sanguine du CA 19-9 ne semble pas spécifique du risque de cancer vésiculaire [43] ;
- le caractère unique d’un PVV ne semble pas augmenter le risque de cancer et n’a pas été retenu comme indication à une cholécystectomie dans les recommandations européennes [12] ;
Pour les PVV de moins de 6 mm et même en présence de facteurs de risque de cancer, la cholécystectomie n’est pas indiquée et seule la surveillance est recommandée (78 %d’accord d’experts, niveau de preuve faible dans les recommandations européennes) [12].
Symptômes cliniques
Tout symptôme attribuable à la vésicule biliaire indique une cholécystectomie prophylactique quelle que soit la taille du PVV, y compris pour les PVV inférieurs à 10 mm (89 %d’accord d’expert, niveau de preuve modéré dans les recommandations européennes) [12].
Les signes cliniques les plus fréquemment rapportés sont des douleurs de l’hypochondre droit et la dyspepsie. La présence de signes cliniques semble prédictive de PVV contrairement aux pseudo polypes [25]. Ces symptômes sont secondaires à une inflammation de la vésicule par le polype, à une obstruction de la lumière du canal cystique par le polype lui-même à l’origine d’une colique hépatique ou d’une cholécystite, ou à une migration de fragments de polypes dans les voies biliaires [2]. Par ailleurs, dans une étude rétrospective, la présence de signes cliniques était corrélée au risque de dégénérescence des PVV ce qui soulignait la nécessité d’une cholécystectomie dans ce contexte [25].
Croissance du polype vésiculaire vrai
Une croissance de plus de 2 mm et/ou l’atteinte du seuil de 10 mm du PVV au cours de la surveillance échographique indique une cholécystectomie prophylactique (respectivement 78 % d’accord d’experts, niveau de preuve modéré et 100 % d’accord d’experts, niveau de preuve modéré dans les recommandations européennes) [12].
Dans plus de 90 % des cas, la taille des PVV reste stable au cours de leur évolution [9]. La croissance d’un PVV doit faire évoquer la possibilité d’une dégénérescence, quelle que soit sa taille initiale. Dans une étude portant sur 1558 patients suivis en moyenne 37 mois, il a été noté 25 % de cancer parmi les polypes ayant grossi. Dans cette même étude, 46 %des polypes ayant dégénéré étaient inférieurs à 10 mm au moment du diagnostic [11].
En résumé, la cholécystectomie prophylactique doit être envisagée en fonction de la taille, de la croissance ou des symptômes cliniques d’un PVV (Fig. 5).
Quelle surveillance pour les polypes vésiculaires vrais de moins de 10 mm ?
La surveillance d’un PVV a pour but de prévenir le cancer vésiculaire ou le détecter à un stade précoce. La surveillance s’effectue par ETC. Dans un souci de reproductibilité, les différents contrôles échographiques doivent être effectués par le même opérateur. Les modalités de cette surveillance sont fonction du contexte (78 % d’accord d’experts, niveau de preuve faible dans les recommandations européennes) [12] :
- pour les PVV de 6 à 9 mm sans facteur de risque de malignité, l’ETC doit être réalisée à 6 mois et à 1 an, puis de manière annuelle jusqu’à 5 ans du diagnostic ;
- pour les PVV inférieurs à 6 mm sans facteur de risque, pour lesquels la surveillance peut être réalisée à 1, 3 et 5 ans du diagnostic initial ;
- au-delà de 5 ans, si la taille reste stable, le diagnostic de PVV est éliminé et la surveillance peut alors être arrêtée [5].
Cholécystectomie : par quelle voie d’abord ?
La cœlioscopie est une voie d’abord possible pour la prise en charge d’un PVV lorsque le risque de dégénérescence est considéré comme faibleLors de l’intervention, la principale préoccupation du chirurgien est de ne pas réaliser de perforation vésiculaire pour éviter toute dissémination tumorale pouvant entraîner une carcinose en cas de polype dégénéré.
Aucune étude comparant la voie ouverte à la cœlioscopie pour la prise en charge d’un PVV n’a été réalisée [44]. Cependant, il n’a pas été montré de morbi-mortalité particulière de la cœlioscopie dans ce contexte et l’approche cœlioscopique est envisageable du fait de ses avantages connus sur la voie ouverte (Fig. 5) [45,46]. Lors de conditions chirurgicales difficiles et que le risque de perforation vésiculaire apparaît important (système adhérentiel complexe, vésicule scléro-atrophique, cholécystite chronique. . .) la voie ouverte doit être privilégiée [47—49]. Il n’existe pas à notre connaissance de recommandation imposant une conversion par voie ouverte en cas de perforation vésiculaire lors d’une cœlioscopie.
La voie ouverte est à envisager en première intention en cas de forte suspicion de polype dégénéré (taille ou envahissement locorégional)
Selon les recommandations japonaises [49] et françaises [50] actuelles sur la prise en charge des cancers de la vésicule biliaire, une chirurgie radicale est à réaliser par voie ouverte, à partir des stades T1b et consiste en une bi-segmentectomie hépatique IV—V (ou résection du lit vésiculaire pour les polypes situés sur le bord libre vésiculaire) associée à un curage ganglionnaire et une recoupe du canal cystique pour examen extemporané (Fig. 5).Certains signes radiologiques d’invasion locorégionale peuvent faire fortement suspecter une dégénérescence en préopératoire (infiltration des tissus péri-vésiculaires, extension intra hépatique, ganglions locorégionaux pathologiques) sans être toutefois spécifiques puisque certaines cholécystites très inflammatoires peuvent entraîner l’apparition d’images d’infiltration des tissus péri-vésiculaires et de volumineux ganglions inflammatoires [51]. Par ailleurs, l’imagerie conventionnelle a une mauvaise spécificité pour affirmer le caractère métastatique des adénopathies. La taille du PVV est le critère le plus prédictif du risque de malignité. En effet, pour les PVV de plus de 15 mm, ce risque est multiplié par 20 (HR : 20,55 95 %IC : 4,3—99,4) et une étude rétrospective sur 109 patients a montré un risque de 80 % de tumeur T1b [52,53].
Aucun de ces critères n’est néanmoins spécifique d’un PVV malin et l’indication d’une exérèse radicale doit s’appuyer sur un faisceau d’arguments après un bilan morphologique exhaustif. Ainsi, un polype de 15 mm ou plus, associé à des signes d’invasion en imagerie, nécessite de discuter une chirurgie radicale en centre expert. Lorsqu’il n’existe pas de signe d’invasion en imagerie, la taille du polype de 15 mm ou plus augmente le risque de dégénérescence et invite à la prudence. Il n’y a pas à l’heure actuelle de recommandations qui permettent de conclure sur le type de chirurgie à proposer dans ces situations.
Si la voie ouverte est recommandée pour la chirurgie radicale, l’approche cœlioscopique n’est cependant plus une contre-indication formelle dans le cancer de la vésicule biliaire. Dou et al. ont montré dans une étude rétrospective sur 63 patients que l’approche cœlioscopique avait des résultats comparables à la voie ouverte, notamment pour les stades tumoraux avancés [54]. Piccolo et al. ont conclu dans une étude rétrospective portant sur 18 patients opérés de chirurgie radicale pour cancers de la vésicule biliaire que l’approche cœlioscopie était réalisable y compris pour les stades T3 [51]. Ome et al. ont également montré sur 52 patients que l’approche cœlioscopique pour traiter des cancers de la vésicule de stade T1 et T2 découverts en pré ou postopératoire n’avait été associée qu’à une seule récidive sur une durée médiane de suivi de 26 mois [55]. Cette voie d’abord peut donc être envisagée dans des centres experts en chirurgie hépato-biliaire mais ne peut encore être recommandée en pratique courante.
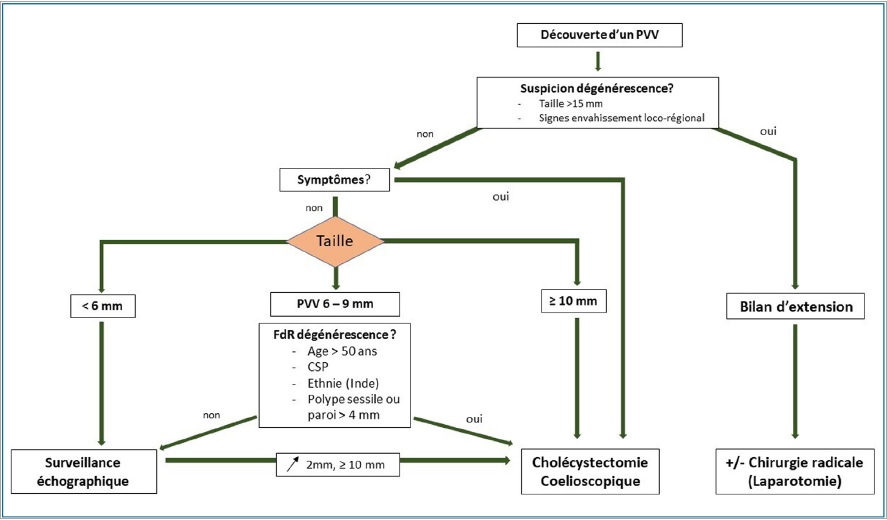
Figure 5.Algorithme de prise en charge d’un polype vésiculaire vrai. FdR : facteurs de risque ; CSP : cholangite sclérosante primitive ; PVV : polype vésiculaire vrai.
Existe-t-il des perspectives non chirurgicales ?
De nouvelles stratégies de prise en charge ont récemment été proposées du fait des progrès de l’endoscopie interventionnelle. Des polypectomies endoscopiques pour PVV à travers la paroi vésiculaire ont été réalisées chez 60 patients à l’aide d’un endoscope souple lors d’une cœlioscopie [56]. Il n’a pas été constaté de récidive sur le long terme. Ces interventions pourraient constituer une alternative à la cholécystectomie mais, du fait d’une effraction de la paroi vésiculaire, elles exposent au risque de dissémination en cas de dégénérescence. Elles ne peuvent donc être recommandées en pratique courante.
Conclusion
Les PVV sont bénins mais exposent à un risque de dégénérescence en adénocarcinome vésiculaire de pronostic sombre. L’échographie abdominale, par un opérateur entraîné, est recommandée en première intention pour le diagnostic positif et la surveillance des PVV. Si le diagnostic de PVV est avéré, une cholécystectomie prophylactique est indiquée chez les patients symptomatiques ou pour tout polype de plus de 10 mm ou supérieur à 6 mm associé à d’autres facteurs de risque de malignité. Dans les autres cas, une surveillance échographique répétée sur 5 ans est recommandée.
En cas de PPV d’aspect bénin, la cholécystectomie prophylactique peut être réalisée par approche cœlioscopie mais toute difficulté opératoire au cours de cette cœlioscopie doit faire envisager une conversion en voie ouverte afin d’éviter une effraction vésiculaire et une éventuelle dissémination tumorale. En cas de forte suspicion de dégénérescence sur le bilan préopératoire (PPV de 15 mm ou plus, infiltration ou adénopathies suspectes), une chirurgie radicale par laparotomie doit être envisagée.
Points essentiels
- Il est important de distinguer les polypes vésiculaires vrais (adénomateux) qui exposent à un risque de dégénérescence des autres formations polypoïdes vésiculaires bénignes (polypes cholestéroliques principalement).
- Une cholécystectomie est indiquée d’emblée en cas de PVV de plus de 10 mm ou de symptômes non attribuables à une autre cause.
- Pour les PVV de moins de 10 mm, la décision de traitement chirurgical dépend de la présence de facteurs de risque de cancer (âge, polype sessile, ethnie indienne ou cholangite sclérosante primitive associée) et de la croissance du polype.
- La cholécystectomie peut être réalisée par voie cœlioscopique. La laparotomie est indiquée en cas de difficultés opératoires avec risque d’effraction vésiculaire.
- La suspicion d’un PVV dégénéré nécessite un bilan morphologique exhaustif à la recherche notamment d’une extension hépatique, et doit faire envisager une intervention radicale par laparotomie.
Déclaration de liens d’intérêts
Les auteurs déclarent ne pas avoir de liens d’intérêts.
Références En savoir plusRemerciement
Nous remercions le Dr. Marie Crinquette de nous avoir permis de présenter l’iconographie de cet article.
© 2020 Elsevier Masson SAS. Tous droits réservés.

